化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

プラスミドDNAの電気泳動の手順
さあ、プラスミドDNAの電気泳動を始めましょう・・・と、そのまえに、電気泳動の結果から正しい情報を抽出できず、貴重なプラスミドを無駄にしてしまった苦い経験はないでしょうか? 電気泳動を成功させる必要条件、それは、プラスミドDNAの「大きさ(鎖長)」と「かたち(立体構造)」の情報を泳動速度に正しく反映できる「分離がよい」ゲルを使うことです。
「分離がよい」ってどんなゲル?
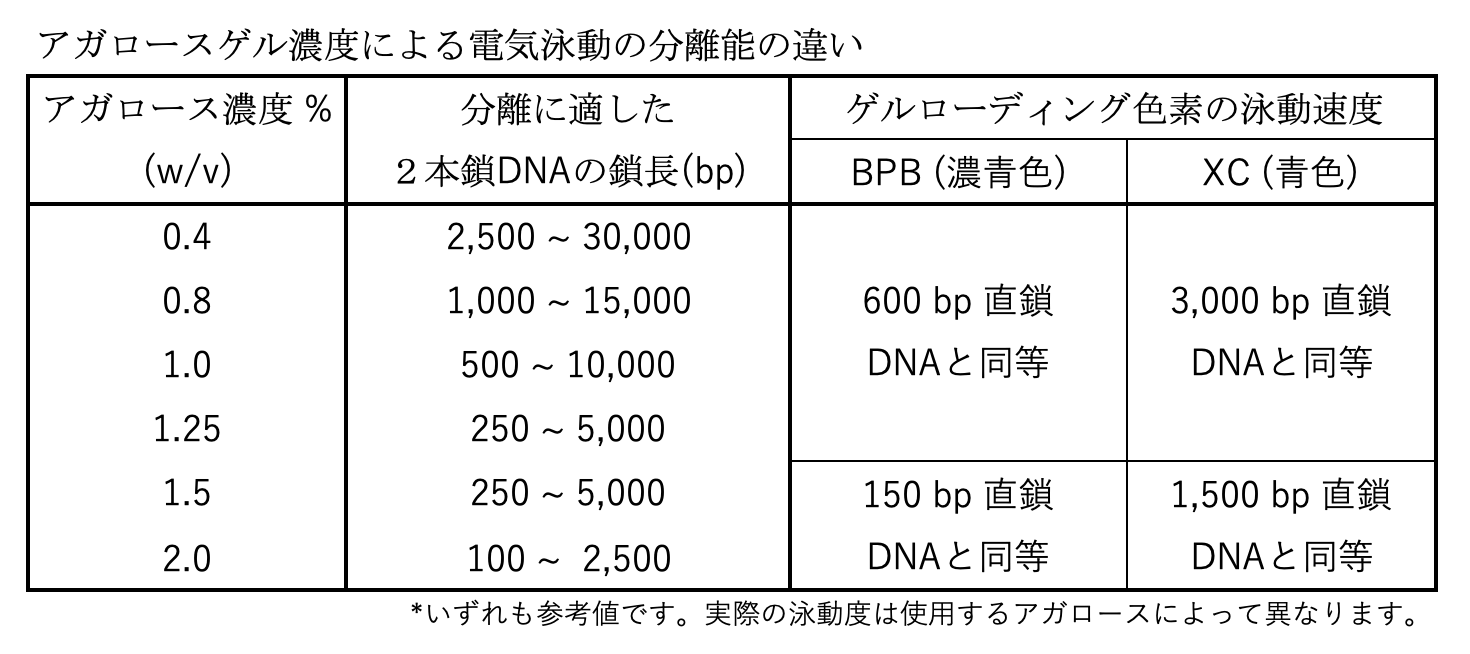
アガロースゲルは、アガロースの濃度が高くなるほどあみ目が細かく、濃度が低くなるほどあみ目が粗くなります。濃度が高過ぎると、大きな(長鎖)DNAはあみ目を通過できず、泳動することができません。反対に、濃度が低過ぎるゲルは、小さな(短鎖)DNAを素通りさせてしまい、ふるいの役割を果たしません。「分離がよい」アガロースゲルとは、泳動するプラスミドの鎖長に適した濃度のゲルのことです。
では、実際に、下記の表と手順を見ながら、「分離がよい」ゲルで電気泳動をはじめてみましょう。
アガロースゲルの作り方
- 必要量のアガロース粉末と1 x TAEバッファーを三角フラスコに入れ、よく混ぜる。
- ラップフィルムで三角フラスコの口をおおい、数箇所の通気穴を開ける。電子レンジで温めてアガロースを溶かす。
*濃度が高いときや混ぜるのが不十分なときには、突沸して高温のゲル液が溢れ出ることがある。熱傷に気をつける。 - <エチジウムブロマイドを事前にゲルに添加する場合> → アガロースが溶けたら、ゲル液100 mLあたり1~10 μLのエチジウムブロマイド溶液(10 mg/mL)を加えて、よく混ぜる。
- 50℃くらいに冷えたら、ゲル液をゲル成型トレイに流し込み、固まるまえにコームを設置する。室温(25℃)で30分ほど静置してゲルを固める。
*ゲルの厚さは、実験の目的やサンプルの体積を目安に決める(5 mmくらい)。
*ゲルに生じた気泡は、チップの尖端などで取り除く。 - ゲルが固まったら、ゲルとトレイのセットを電気泳動槽に移す。
*ゲルをすぐに使わないときには、1 x TAEバッファー中で蓋つきの容器で保管できる。 - ゲルの上面まで5 mmくらいの深さになるように1 x TAEバッファーを注ぎ、コームをゲルから静かに外す。
電気泳動の手順
- DNA溶液と6 xゲルローディングバッファーを体積比5:1で混ぜて(6倍希釈)、電気泳動試料(サンプル)とする。
- マイクロピペットを使ってウェルにサンプルを静かにアプライする。
*ゲルローディングバッファーは泳動バッファーより比重が大きいので、サンプルはウェルの底に沈む。 - DNA分子量マーカー(1 kbラダーなど)を空いたレーンにアプライする。
- パワーサプライで定電圧をかけ、電気泳動をはじめる。
*泳動バッファーが1xTAEの場合は、ゲルの長さ10 cmあたり50 Vくらいの定電圧が目安。
*泳動中にゲルが動いたり、浮き上がらないように注意する!
*通電中は電気泳動槽に指などを入れない。感電の危険性あり!
*放熱が不十分のまま高電圧/長時間の泳動をすると、高温になりゲルが溶けてしまう! - ゲルローディングダイ(色素:BPB, XC)の泳動を目安に[表1]、電気泳動を止める。
- <手順3でゲルにエチジウムブロマイドを添加した場合> → ステップ15に進む。
<手順3でゲルにエチジウムブロマイドを添加していない場合> → ステップ13, 14 (染色操作)に進む。 - エチジウムブロマイド染色液を調製する。ゲルが十分に浸る分量の泳動バッファーを容器に入れ、100 mLあたり1~10 μLLの割合でエチジウムブロマイド溶液(10 mg/mL)を加えて、よく混ぜる。
- エチジウムブロマイド染色液にゲルを浸し、室温で30分間ほど穏やかに振盪する。
- トランスイルミネーターのUV(紫外)光照射板にゲルを置き、260 nmの波長の光を含む UV光を照射する。
*ゲル中からDNAを回収する場合には、UV光照射によるDNAの損傷を最小限に抑える(UV光の照射時間を最小限にする。260 nmより短波長のUV光を使用しない。) - DNA試料の泳動結果を観察し、記録する。必要に応じてDNAバンドの定量を行う。
*UV光は目や肌を傷害するため、UV光をカットするフィルターやカメラ付き撮影装置を用いて観察する。
この記事は、理系研究職の方のキャリア支援を行うパーソルテンプスタッフ研究開発事業本部(Chall-edge/チャレッジ)がお届けする、実験ノウハウシリーズです。
次回は、結果を正しく読むためのポイントについて解説します!
*監修
パーソルテンプスタッフ株式会社
研究開発事業本部(Chall-edge/チャレッジ)
研修講師(理学博士)
関連記事Recommend
-

細胞の免疫蛍光染色 実践編(2/2)
リケラボ実験レシピシリーズ
-

細胞の免疫蛍光染色 基本編(1/2)
リケラボ実験レシピシリーズ
-

細胞内でRNA干渉を人為的に誘導するために RNA干渉による遺伝子発現の調節(2/2)
リケラボ実験レシピシリーズ
-

RNA干渉(RNA interfering, RNAi)とは? RNA干渉による遺伝子発現の調節(1/2)
リケラボ実験レシピシリーズ
-

免疫沈降法(Immunoprecipitation)による目的タンパク質の濃縮 基本から応用まで
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(3/3)ウェスタンブロットによるタンパク質の検出
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(2/3)培養細胞抽出液のSDSポリアクリルアミド電気泳動
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(1/3)タンパク質実験をはじめるための基礎知識
リケラボ実験レシピシリーズ
-

リポフェクション法による遺伝子導入のプロトコル
リケラボ実験レシピシリーズ トランスフェクション(2/2)
-

遺伝子導入技術 トランスフェクションの基礎知識
リケラボ実験レシピシリーズ トランスフェクション(1/2)