化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

生物の身体を構成する1つ1つの細胞は、生命を形作る最小の単位(ユニット)として知られています。細胞内で行われる全ての生命活動は「マニュアル」に従って制御されています。「マニュアル」は、遺伝情報としてDNAやRNAによって保持されています。以前、遺伝情報を任意に書き換える遺伝子組み換え技術についてご紹介しましたが、意図的にデザインしたDNAやRNAを細胞内に入れ、この「マニュアル」を追加・編纂することはできるのでしょうか?
ここでは、そのような、生命を脚色しうる遺伝子導入技術、「トランスフェクション」についてご紹介します。
トランスフェクションとは?
真核細胞にDNAやRNAといった遺伝情報を持った核酸物質を導入する技術をトランスフェクション(Transfection)と呼びます。近年では、タンパク質の細胞内導入技術も実用化され、広義のトランスフェクションとして理解されています。トランスフェクションは、遺伝子発現の調節機構や遺伝子産物の細胞内機能の解析、組み換えタンパク質の産生、遺伝子治療の基礎研究などで用いられ、生命科学研究で最も重要な技術のひとつです。いくつかの主要なトランスフェクション法を例として、その分類・原理・手順・特徴・注意点などをおさらいしましょう。
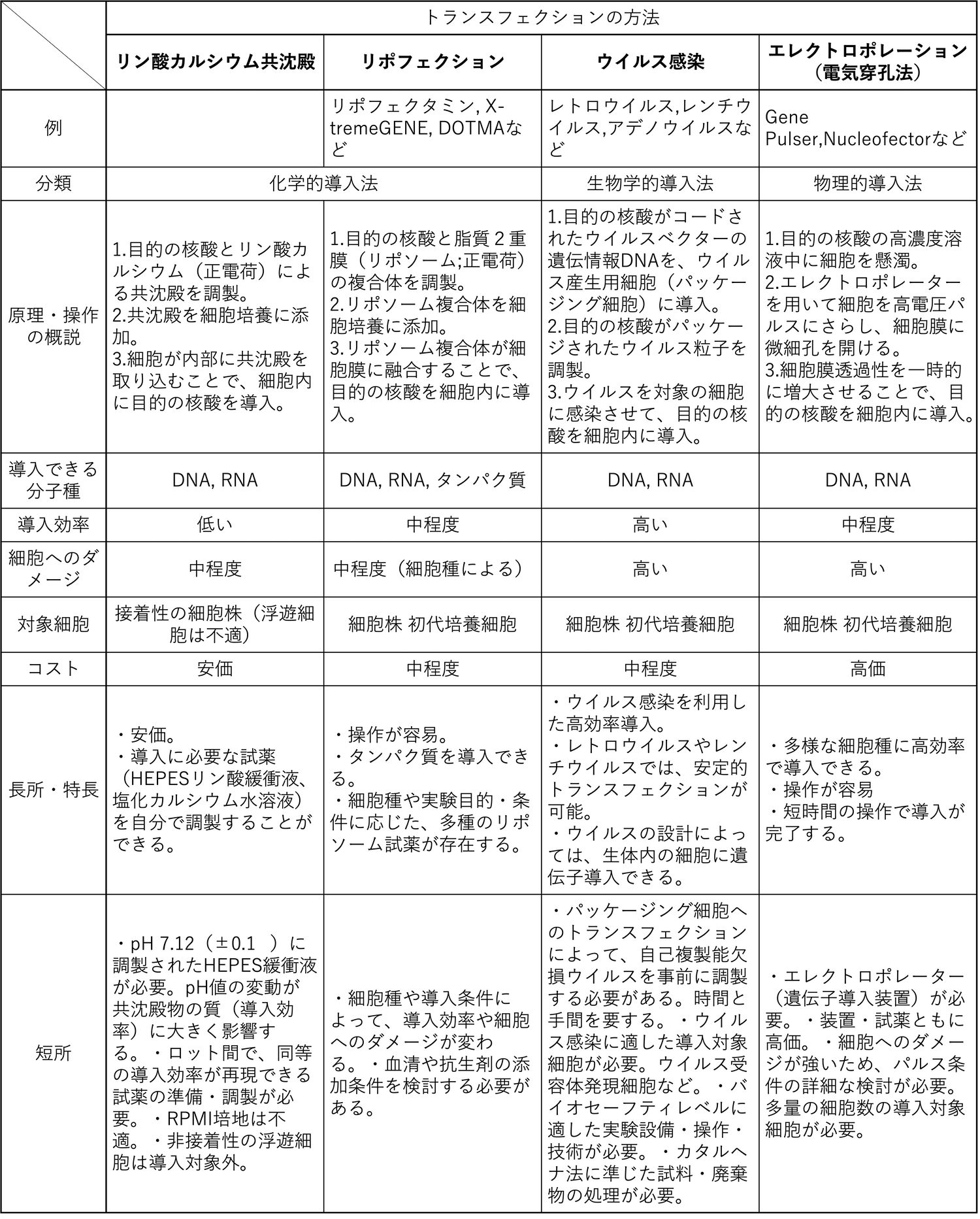
トランスフェクションの方法による分類
DNAやRNAは負に帯電する高分子であり、同じく負に帯電する細胞膜(リン脂質の2重膜)を透過して細胞内に浸透することは、通常ほとんど起こりません。したがって、これら目的の核酸分子を細胞内に送達するトランスフェクションには、「①:正に帯電したキャリア分子と結合させて目的の核酸の負電荷を中和(マスク)する」あるいは「②:細胞膜に微細な孔を開けて目的の核酸を通過させる」技術が必要となります。現在用いられている多種のトランスフェクション法は、その原理から「化学的手法」、「生物学的手法」、「物理的手法」の3種に大別でき、いずれの方法も上記①または②の達成をすることで目的の核酸の細胞内導入を実現します。
化学的トランスフェクション法
核酸と正電荷をもつキャリア分子(脂質2重膜(リポソーム)、ポリマー、リン酸カルシウムなど)の複合体を調製し、この核酸複合体を細胞内に送達する方法。
例)リポフェクション、DEAE-デキストラン法、ポリエチルイミン法、リン酸カルシウム共沈殿法など
生物学的トランスフェクション法
遺伝子改変ウイルスの粒子内に目的の核酸をパッケージングし、ウイルス感染によって対象の細胞に目的の核酸を送達する方法。
例)レトロウイルス、レンチウイルス、アデノウイルス、アデノ随伴ウイルス、ヘルペスウイルスなど
物理的トランスフェクション法
細胞膜の一時的な部分損傷や、細胞質/細胞核への直接注入などによって、核酸を細胞内に送達する方法。
例)エレクトロポレーション(電気穿孔法)、マイクロインジェクション(微量注入法)、遺伝子銃導入、マグネットフェクション(磁気導入)など
トランスフェクションを始める前に行うべき、最も大切な準備
トランスフェクションに使用する細胞の継代と観察を、1〜2週間程度、自分で行ってみましょう[細胞培養の項を参照]。そもそも、自分の手で、培養細胞を調子が良い(指数関数的に増殖する)状態に維持することができなければ、トランスフェクション実験の成功は見込めません(成功/失敗の判別もつきません)。
→細胞培養の一連の無菌操作を丁寧に・落ち着いて行うことで、細胞へのダメージを最小限に抑えることができます。また、各操作の前後に、細胞を顕微鏡で注意深く観察する習慣を身につけることも大切です。
→調子が良い状態(指数関数的増殖期)の細胞の特徴(細胞形態、細胞倍化時間(ダブリングタイム)、トリプシン処理への感度、播種後の培養ディッシュへの接着性など)を把握する。顕微鏡観察を行うだけで、その細胞の状態を概ね判別できることが目標となります。
トランスフェクション実験で注意すべきポイント
- 核酸の導入効率が最良、かつ導入細胞へのダメージが最小となるトランスフェクション方法の選択、導入条件の設計が理想的。
→ 導入効率が良い方法ほど、細胞へのダメージが大きくなる傾向がある。
→ 高効率導入の達成には、僅かなダメージや細胞死は許容せざるを得ない。
- 継代操作による損傷から回復した細胞を使用することでトランスフェクションの悪影響が抑えられる。継代後24時間以上経過した細胞など。
- コンタミネーション(微生物汚染)した細胞は適さない[細胞培養の項を参照]。
→ 培地への抗生物質の添加などの方法で、微生物汚染を防止することができる。
→リポフェクションなどでは、抗生物質を添加することで細胞へのダメージが著しく大きくなることがある。
- 活発に分裂している細胞は、静止状態の細胞(老化細胞など)よりも導入効率が良い[細胞培養の項を参照]。
→過密培養により増殖が抑制された細胞は、導入効率が良くない。また、培養密度が低すぎる過疎培養の細胞は、トランスフェクションによるダメージが大きくなる。
→ がん細胞を由来とする細胞株と比較して、初代培養細胞などへの導入は細胞が持つ性質から困難な場合が多い。
- 培地中の血清は細胞増殖を促して導入効率を良くするが、リポフェクションを阻害する。RNA導入時には無血清培地を使用して、混入RNaseによるRNAの分解を最小限にする配慮が必要。
- 浮遊細胞(血液細胞など)は、接着細胞よりも導入効率が低下する。
- 導入する核酸が多量あるいは長鎖になるほど、導入効率が低下する。
- 導入する核酸溶液中の混入物(高塩濃度, フェノール, エンドトキシンなど)は、導入効率の低下を招いたり、細胞にダメージを与える。
- スーパーコイル状のプラスミドDNAは、直鎖状のDNAと比べて、細胞内への導入効率が高い[プラスミドDNAの項を参照]。
→ 細胞内に導入された直鎖状DNAは、スーパーコイル状DNAと比べて、高効率で宿主ゲノム内に組み込まれやすい(安定的トランスフェクション, Stable transfection)。
主なトランスフェクション法の特徴を下表で概説します。
上表を参考に、実験の目的や導入対象の細胞種に適したトランスフェクションを実際に行なってみましょう。
*監修
パーソルテンプスタッフ株式会社
研究開発事業本部(Chall-edge/チャレッジ)
研修講師(理学博士)
この記事は、理系研究職の方のキャリア支援を行うパーソルテンプスタッフ研究開発事業本部(Chall-edge/チャレッジ)がお届けする、実験ノウハウシリーズです。
過去の記事一覧:実験レシピシリーズ
関連記事Recommend
-

細胞の免疫蛍光染色 実践編(2/2)
リケラボ実験レシピシリーズ
-

細胞の免疫蛍光染色 基本編(1/2)
リケラボ実験レシピシリーズ
-

細胞内でRNA干渉を人為的に誘導するために RNA干渉による遺伝子発現の調節(2/2)
リケラボ実験レシピシリーズ
-

RNA干渉(RNA interfering, RNAi)とは? RNA干渉による遺伝子発現の調節(1/2)
リケラボ実験レシピシリーズ
-

免疫沈降法(Immunoprecipitation)による目的タンパク質の濃縮 基本から応用まで
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(3/3)ウェスタンブロットによるタンパク質の検出
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(2/3)培養細胞抽出液のSDSポリアクリルアミド電気泳動
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(1/3)タンパク質実験をはじめるための基礎知識
リケラボ実験レシピシリーズ
-

細胞培養の手ほどき(2/2)細胞培養プロトコル
リケラボ実験レシピシリーズ
-

細胞培養の手ほどき(1/2)
リケラボ実験レシピシリーズ