化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

プラスミドの電気泳動結果を「読む」とは、どのような意味でしょうか?それは、「分離の良い」ゲルに泳動したDNAの蛍光強度から量を、位置からプラスミドの鎖長とかたちを推定することです。ここでは、電気泳動写真からプラスミドの「量」・「鎖長」・「かたち」を読み解くためのヒントをご紹介しましょう。
プラスミドの量を知るために -エチジウムブロマイド染色の原理-
エチジウムブロマイド染色をすると、DNAがゲルの中で明るく光ります。実は、このしくみを知ることが、電気泳動を定量的に理解するための第一歩になります。核酸は260nmの波長の紫外(UV)光をピークとして光を吸収します。DNAは鎖の内部にエチジウムブロマイドが挿入されると、吸収したUV光のエネルギーを効率良くエチジウムブロマイドに転移します。一方、エチジウムブロマイド自身の吸光波長は300nmです。エチジウムブロマイド染色したゲルを(300nmの波長を含まずに)260nmの波長を豊富に含むUV光で照らすと、DNAからエネルギー転移を受けたエチジウムブロマイドのみが蛍光を発します。この蛍光強度は、挿入されたエチジウムブロマイド分子の数に比例します。エチジウムブロマイドの挿入はDNA鎖の量(鎖長×本数)に比例します。
この電気泳動の定量性のしくみは、実験条件が次の3つの前提をすべて満たす場合にのみ成り立ちます。解析のまえのご確認を忘れずに:① エチジウムブロマイドの量が測定対象のDNAと比べて十分である(飽和条件);②照射されるUV光強度が解析対象のDNAバンドの間でばらつきがない;③蛍光強度が検出機器のダイナミックレンジ内である。
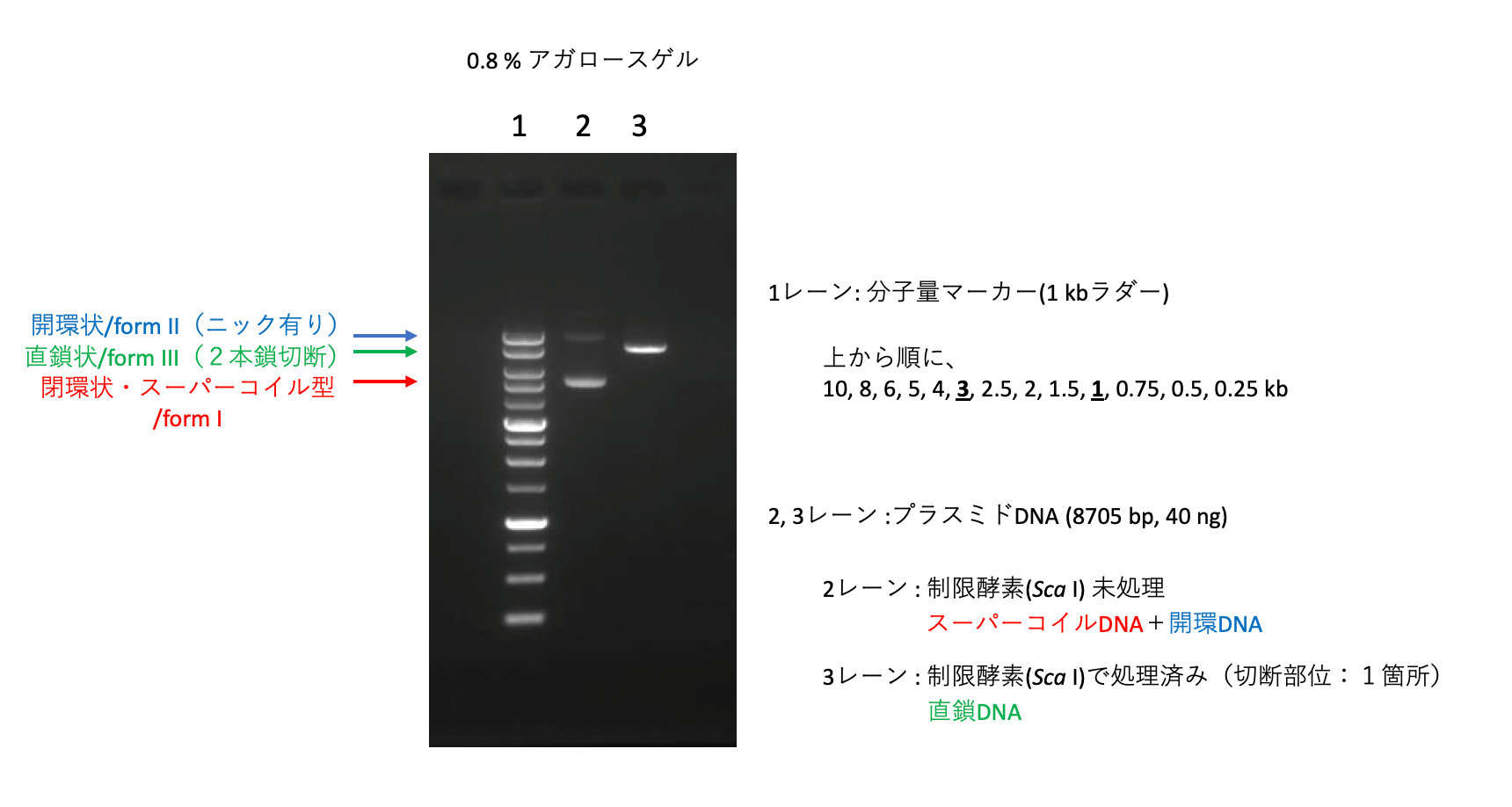
プラスミドのかたちと鎖長を知るために -DNA鎖の3種のフォームとは-
同じかたちのプラスミドは、長鎖(高分子量)になるほど泳動が遅くなりました。では、同じ鎖長のDNAは、どれも同じ速さで泳動されるのでしょうか?ここでは泳動の速さを左右するもうひとつの要因、プラスミドのかたちについて見ていきましょう。
プラスミドDNAを大腸菌などから適切な方法で精製すると、得られるDNAの多くは、閉環状(スーパーコイル型/フォームI)の構造になります。

一方で、精製中の物理的・化学的ストレスなどによって、一部の閉環状プラスミドが1本鎖切断(ニック)または2本鎖切断を受け、それぞれ開環状プラスミド(フォームII)や直鎖状DNA(フォームIII)が生じます。


そのため、実際のプラスミド試料は、鎖長(分子量)が等しい3種のかたちのDNAの混ざりものになります。開環状のプラスミドは、閉環状や直鎖状の同じDNA分子と比べて立体的にかさ高いため、両者よりもゆっくりと泳動されます。閉環状DNAと直鎖状DNAでは、鎖長・ゲルの濃度・泳動バッファー・電圧などの条件によって泳動速度の序列は変わります。
プラスミドDNAを制限酵素で完全に2本鎖切断すると、3種のかたちが混ざった状態から直鎖状DNAだけを含む試料に変わります。分子量マーカーのDNAは直鎖状分子のため、制限酵素で処理をすることで、試料DNAの鎖長を推定することができるようになります。
エチジウムブロマイド処理はDNAの泳動結果を変化させる?
エチジウムブロマイドを事前に添加したゲルで電気泳動をおこない、試料DNAが他レーンの同等DNAよりも速く(または遅く)泳動されたという不思議な経験をしたことはないでしょうか?これは泳動前にゲルに添加したエチジウムブロマイドの電気泳動中の振る舞いに関係しています。
エチジウムブロマイドは、DNAとは反対に正の電荷をもち、陽極から陰極に泳動されます。泳動中にDNAと出会うと両者が結合し、DNA-エチジウムブロマイド複合体ができます。複合体中のDNAは、結合していないDNAと比べて、エチジウムブロマイドの正電荷の分だけ負電荷が相殺されるため、陽極への泳動が遅くなります。エチジウムブロマイドの量がDNAに比べて十分なときには、DNAはエチジウムブロマイドと速やかに結合して、エチジウムブロマイドに飽和します。一方で、DNA量がエチジウムブロマイドに比べて過多なときには、DNAがゲル(レーン)中のほぼ全てのエチジウムブロマイドと結合するため、同じレーン内の複合体が泳動された後方にはエチジウムブロマイドの空白(低濃度)域が生じます。試料中にこの空白域内を続いて泳動されるDNAがあるときには、後続DNAは十分量のエチジウムブロマイドと結合できないため、エチジウムブロマイドに飽和したときよりも泳動が速くなります。
このDNA(核酸)の泳動に対するエチジウムブロマイドの干渉は、RNAに対しても同じように起こります。実際に、過多のRNA夾雑物を含むDNA試料を電気泳動すると、先行する多量のRNAとの結合によってレーン中のエチジウムブロマイドが消費され、後続のDNAの泳動が速くなります。このアーティファクトとも言える現象は、電気泳動後にエチジウムブロマイド染色を行うこと(「プラスミドDNAの電気泳動1/3」をご参照ください)、または電気泳動前に試料中のRNAを除去/分解することで防ぐことができます。
この記事は、理系研究職の方のキャリア支援を行うパーソルテンプスタッフ研究開発事業本部(Chall-edge/チャレッジ)がお届けする、実験ノウハウシリーズです。
*監修
パーソルテンプスタッフ株式会社
研究開発事業本部(Chall-edge/チャレッジ)
研修講師(理学博士)
関連記事Recommend
-

細胞の免疫蛍光染色 実践編(2/2)
リケラボ実験レシピシリーズ
-

細胞の免疫蛍光染色 基本編(1/2)
リケラボ実験レシピシリーズ
-

細胞内でRNA干渉を人為的に誘導するために RNA干渉による遺伝子発現の調節(2/2)
リケラボ実験レシピシリーズ
-

RNA干渉(RNA interfering, RNAi)とは? RNA干渉による遺伝子発現の調節(1/2)
リケラボ実験レシピシリーズ
-

免疫沈降法(Immunoprecipitation)による目的タンパク質の濃縮 基本から応用まで
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(3/3)ウェスタンブロットによるタンパク質の検出
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(2/3)培養細胞抽出液のSDSポリアクリルアミド電気泳動
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(1/3)タンパク質実験をはじめるための基礎知識
リケラボ実験レシピシリーズ
-

リポフェクション法による遺伝子導入のプロトコル
リケラボ実験レシピシリーズ トランスフェクション(2/2)
-

遺伝子導入技術 トランスフェクションの基礎知識
リケラボ実験レシピシリーズ トランスフェクション(1/2)