化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

前回はDNAクローニングの予備知識を解説しました。以降、実際の手順を流れに沿って説明していきます。
この記事は、理系研究職の方のキャリア支援を行うパーソルテンプスタッフ研究開発事業本部(Chall-edge/チャレッジ)がお届けする、実験ノウハウシリーズです。
制限酵素によるインサートとベクターの切断
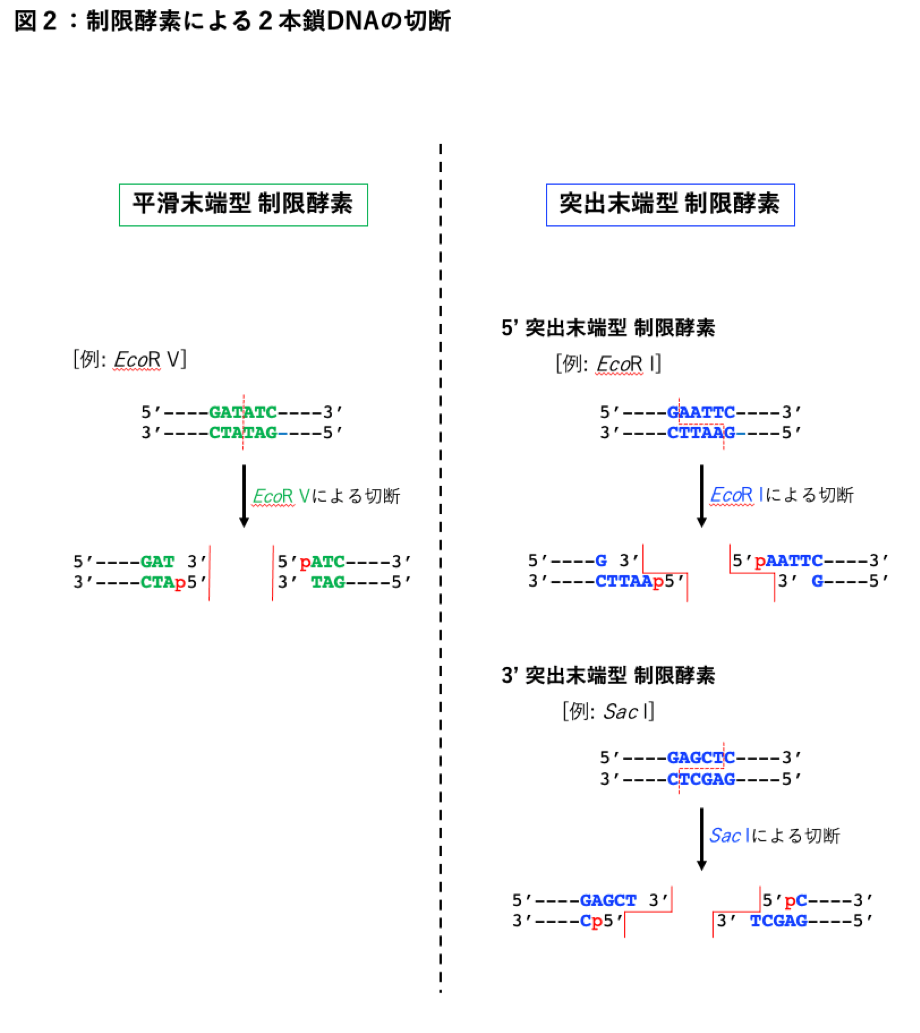
プラスミドベクターのクローニングサイトにインサートをライゲーションするためには、インサ一卜DNAの末端の形状に合わせてベクターを切断しなければなりません。2本鎖DNAの切断は、制限酵素(制限エンドヌクレアーゼ)を用いて行います。制限酵素によりDNAのホスホジエステル結合が切断されると、切断部に新たに生じる3’末端はヒドロキシル基となり、新たに生じる5’末端にはリン酸基(p)が付加されます [図2] 。
インサートが平滑末端をもつ場合には、ベクターも適当な平滑末端型の制限酵素で切断します。一方、インサートが突出末端の場合には、インサートとベクターの末端の突出部を互いに相補的な塩基配列にする必要があります。したがって、多くの場合は、インサートを切断した制限酵素と同じ制限酵素でベクターを切断・開環することになります(異なる制限酵素が互いに相補的な突出部分を形成する場合もあります(BamHIとBglII、SalI とXhoI など)。
また、インサートDNAの両末端の構造が異なる場合には、ベクターのクローニングサイトをそれに対応した2種類の制限酵素で切断する必要があります。この場合は、ベクターに対して一方向性にインサートがライゲーションされるため、インサートを特定の向きに挿入しなければならないクローニング実験によく用いられます(発現ベクター構築実験など)。
実験手順
1. 下記の試薬をマイクロチューブに入れ、反応液を調製する。インサートDNAとベクターDNAのそれぞれに対して制限酵素反応を行う。はじめに超純水を入れ、続いてバッファーからDNAまで順に試薬を加えていく。*1
10xバッファー *2………2 μL
BSA (牛血清アルブミン) *3………0.01 %
制限酵素 (5 U 程度) *4………n μL
DNA(インサート or ベクター)………1 μg *5
超純水……… m μL
合計………20 μL
2. 制限酵素の最適温度で3時間ほどインキュベートを行い、DNAを完全に切断する。*6
3. 200 ng 程度のDNAを含む反応液の一部を用いて、アガロース電気泳動を行い、切断反応の進行状況を確認をする。*7
4. 切断が確認された反応液の残り(18 μL)に 6 x ゲルローディングバッファーを加え*8、制限酵素反応を停止する。
5. 制限酵素反応を終えたDNA試料のアガロース電気泳動を行う。*9
6. 「切断により開環したプラスミドベクター」と「インサート」のDNAバンドを含むゲル片をそれぞれ回収する*9。得られたゲル片からベクターとインサートをそれぞれ抽出・精製する。*10
<制限酵素反応を成功させるための注意点!>
*1 複数のプラスミド試料を同時に切断するときには、プラスミド以外の試薬を入れたプレミックスをあらかじめ試料数分だけ調製し、必要量をそれぞれのチューブに分注するとよい。
*2 制限酵素に添付されている10xバッファー(10倍濃縮バッファー)を用いる。
*3 BSA添加の要・不要は制限酵素ごとあるいは製品ごとに異なる。製品のカタログなどで事前に確認する。
*4 U: ユニット。一般的に制限酵素は 5~20 U/μL の濃度で販売されているため、1.0 μL 程度の酵素液が必要になる。制限酵素の添加量が反応系の全体積の10%を超えると、制限配列と無関係な非特異的な切断(スター活性)が生じてしまう。
*4 制限酵素認識配列中の塩基がメチル化を受けると、メチル化された塩基の種類および位置によっては、そのDNAを切断できなくなる酵素がある(メチル化感受性制限酵素)。
*5 以降に行うDNA断片の回収操作などでロスが生じる可能性が考えられるため、予備を含む。
*6 多くの制限酵素は37度が最適条件。各制限酵素のカタログなどで確認する。
*7 同様に調製した未切断のプラスミド試料を同じゲルで泳動する(対照実験)。[プラスミドの電気泳動]の項を参照。
*8 [プラスミドの電気泳動]の項を参照。
*9 インサート/ベクターともに制限断片の長さを主な指標として、回収するDNAバンドを決める。ベクターでは、基本構造(DNA複製配列、抗生剤耐性遺伝子発現系)をもつ断片を回収する。
*10 シリカメンブレン・スピンカラムあるいはガラスビーズ・プルダウンなどに基づいたDNA抽出・精製キットを使用する。
*次回は、ライゲーション反応を成功させるポイント について解説します。
*監修
パーソルテンプスタッフ株式会社
研究開発事業本部(Chall-edge/チャレッジ)
研修講師(理学博士)
関連記事Recommend
-

細胞の免疫蛍光染色 実践編(2/2)
リケラボ実験レシピシリーズ
-

細胞の免疫蛍光染色 基本編(1/2)
リケラボ実験レシピシリーズ
-

細胞内でRNA干渉を人為的に誘導するために RNA干渉による遺伝子発現の調節(2/2)
リケラボ実験レシピシリーズ
-

RNA干渉(RNA interfering, RNAi)とは? RNA干渉による遺伝子発現の調節(1/2)
リケラボ実験レシピシリーズ
-

免疫沈降法(Immunoprecipitation)による目的タンパク質の濃縮 基本から応用まで
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(3/3)ウェスタンブロットによるタンパク質の検出
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(2/3)培養細胞抽出液のSDSポリアクリルアミド電気泳動
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(1/3)タンパク質実験をはじめるための基礎知識
リケラボ実験レシピシリーズ
-

リポフェクション法による遺伝子導入のプロトコル
リケラボ実験レシピシリーズ トランスフェクション(2/2)
-

遺伝子導入技術 トランスフェクションの基礎知識
リケラボ実験レシピシリーズ トランスフェクション(1/2)