化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

この記事は、理系研究職の方のキャリア支援を行うパーソルテンプスタッフ研究開発事業本部(Chall-edge/チャレッジ)がお届けする、実験ノウハウシリーズです。
PCRを正しく行うための予備知識1
PCRはポリメラーゼ連鎖反応と日本語に訳され、たった数時間で任意のDNAを数千万倍以上に増幅できる、魔法のような化学反応です。PCRの開発により、検出できないほど微量なDNAを目に見えるほど多量に増幅することが簡単にできるようになり、分子生物学、医学、遺伝学、育種学、薬学のみならず、臨床診断、犯罪捜査、考古学などの分野にも一大革新がもたらされました(1993年 ノーベル化学賞受賞)。
昨今では、PCRを応用し、人類の体内に共生/感染している細菌やウイルスの微量なゲノムを、定量的に検出できるようになりました。新型コロナウイルス(SARS-CoV-2)のパンデミック(世界的大流行)に直面している2020年代では、PCRはウイルス感染の有無を可視化する最有力な手段であり、その名を耳にしない日はありません。 今まさにホットな、そして今後も更なる効果的な応用が期待されるPCRを、生化学・分子生物学的な視点からおさらいしましょう。
1. PCR/ポリメラーゼ連鎖反応とは?
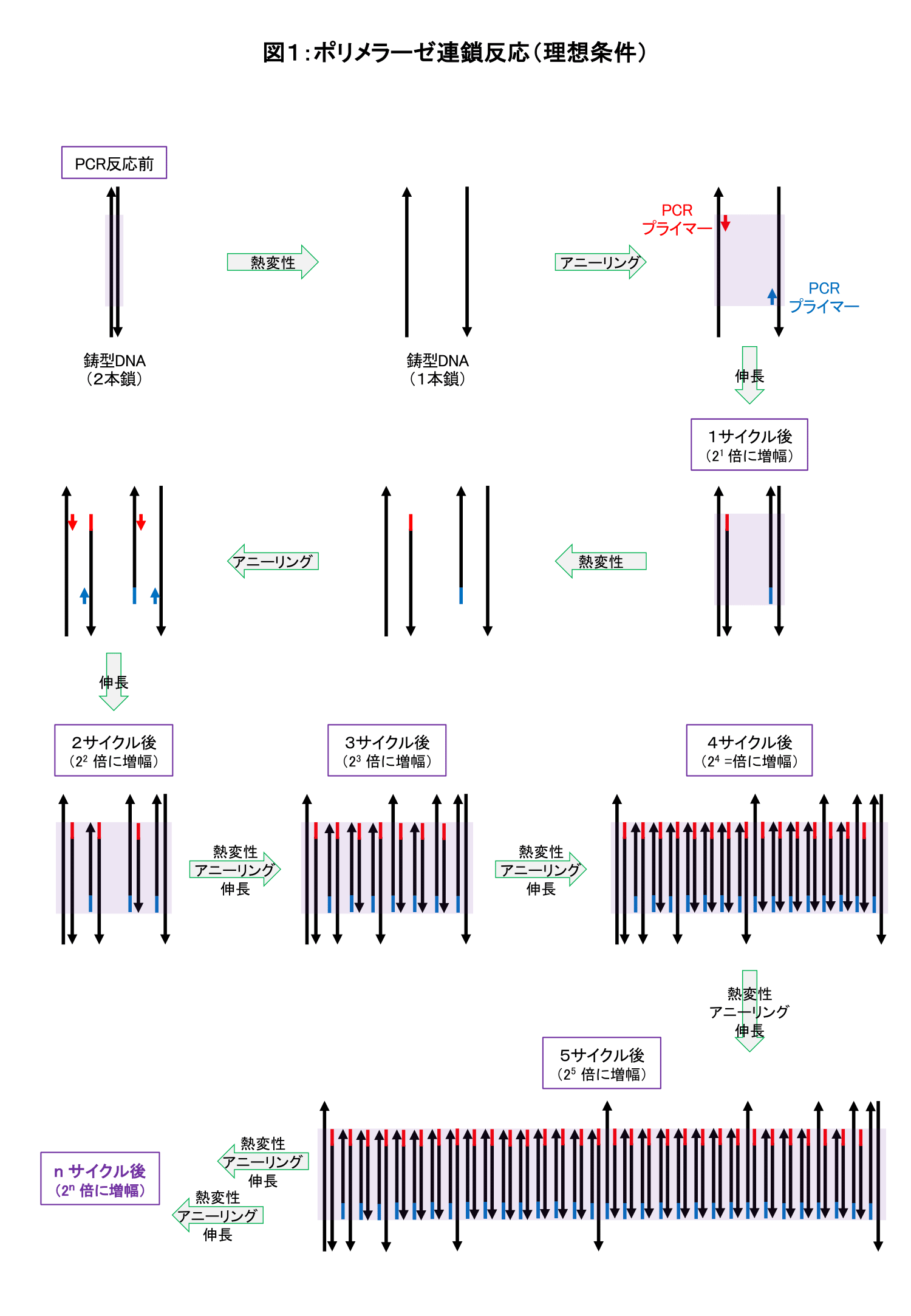
PCRとは、Polymerase Chain Reaction(ポリメラーゼ連鎖反応)の略で、DNAポリメラーゼを用いて、任意の鋳型DNAの相補的DNAを連鎖的に合成する反応です。 PCRでは、以下の工程1→2→3を順に行うことを「1サイクル」として、この基本単位を20〜30サイクル繰り返すことで、数時間のうちに目的のDNA断片のコピー数(モル数)を数千万倍以上(約220~230倍)に増幅することができます。
PCRのサイクル反応
- 鋳型DNAの熱変性(Denaturing)
→加熱により、2本鎖構造の鋳型DNAを1本鎖に解離する。 - PCRプライマーのアニーリング(Annealing)
→冷却して、PCRプライマーを鋳型DNA鎖の増幅したい部位の両端に結合させる。2本鎖構造を部分的にもつ鋳型DNAが生じる。 - ポリメラーゼによるDNA鎖の伸長反応(Extension)
→デオキシヌクレオシド三リン酸(dNTP)を基質とし、アニーリング部位を開始点として、鋳型DNAの相補鎖を合成する。
PCRでは、各サイクルのポリメラーゼ反応の生成物が、次のサイクルの鋳型となります(連鎖反応)。そのため、PCRの過程でサイクル回数が増えるにつれて、生成物量は指数関数的に増加します。
2. PCRの速度論〜PCR反応の定量性を理解するために〜
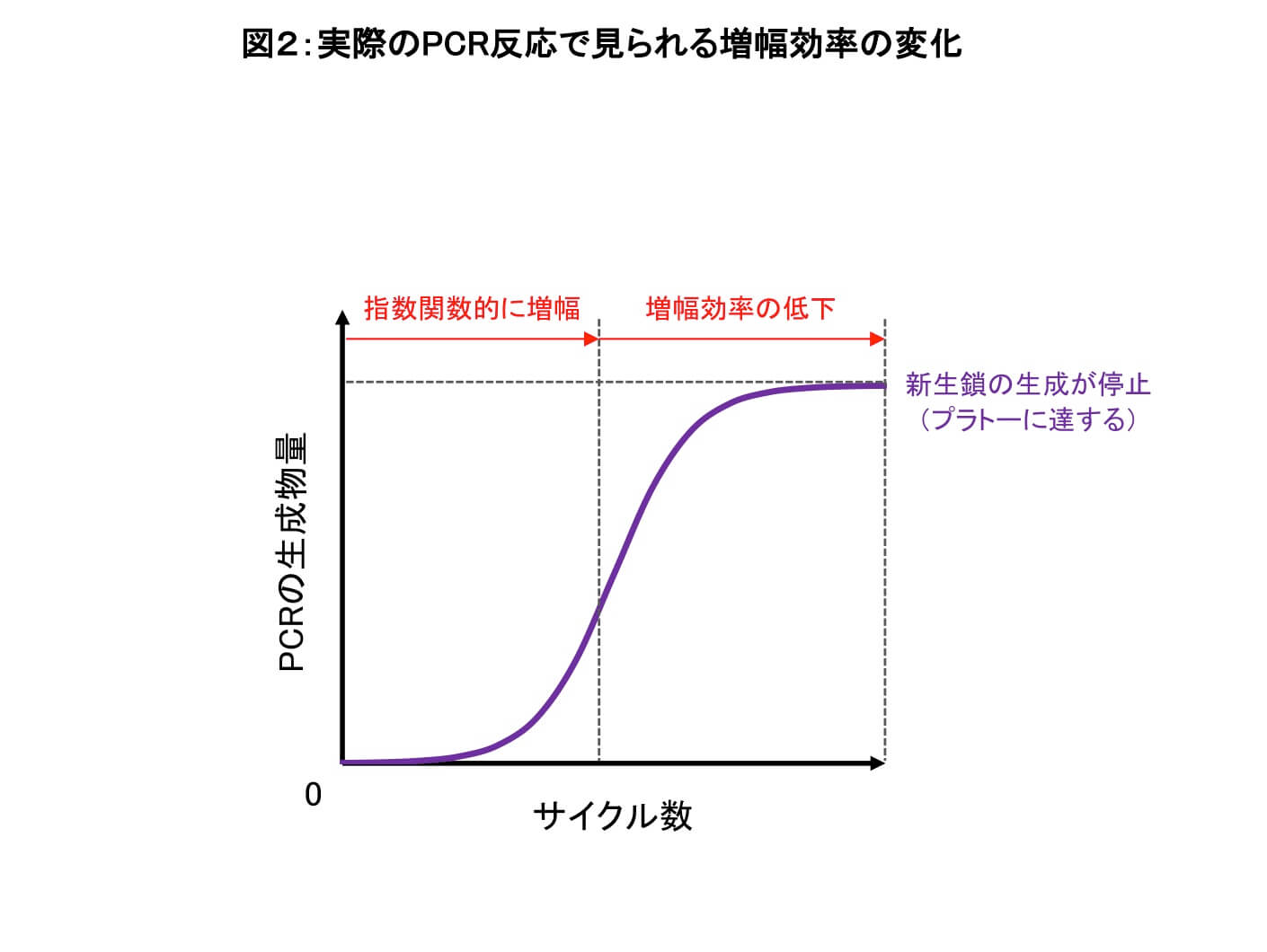
PCRは、目的のDNAを指数関数的に増幅することができる、DNA合成の連鎖反応として知られています。しかしながら、実際に試験管内で起こるPCRでは、目的のDNAを無制限・無尽蔵に増やすことはできません。
ポリメラーゼ反応の特徴から、「1サイクルの反応を経て、目的のDNA断片のモル数が2倍になる」ことが予想されます。この理想的な反応条件では、初期の鋳型DNA量をIとすると、nサイクル後の反応生成物量yは、次式のようになります。
- y = I x 2ⁿ (理想条件でPCRを行った場合)
一方、理想条件とは対照的に、試験管内で実際に行われるPCRでは、以下のように反応が進行します。
- 各サイクルでの増幅効率が、必ずしも2倍にはならない
→プライマーのアニーリング効率やDNA鎖の伸長の効率が100%ではないため。 - サイクル回数が少なく、反応生成物が相対的に少ないうちは、反応生成物量はサイクル回数の増加にともない指数関数的に増加する。
- 十分なサイクル回数に達し、反応生成物が相対的に多くなると、サイクル回数の増加にともなって増幅効率が低下するようになる。その後、サイクルを繰り返しても新生鎖が得られなくなり、生成物量はプラトーに達する(PCR反応の停止)。
→反応停止の要因:DNAポリメラーゼの失活、反応基質(dNTP)やPCRプライマーの枯渇、反応の副産物(ピロリン酸)によるポリメラーゼ反応の阻害、生成したDNA鎖同士の再会合によるプライミングの阻害など。
このように、実際のPCRでは「十分なサイクル回数に達した場合には、初期鋳型DNAの量(モル数)に関わらず、ほぼ同じ量(モル数)のPCR反応生成物が得られる」ことが推察されます。この点の理解は、定量的PCR解析を行う際には欠くことができません。(定量的PCRについては、追ってこのシリーズでも解説する予定です)。
※図1,2とも制作者、研修講師(理学博士)の許可を得て掲載
次回は、反応系をデザインする際に抑えるポイントを概説します。
*監修
パーソルテンプスタッフ株式会社
研究開発事業本部(Chall-edge/チャレッジ)
研修講師(理学博士)
過去の記事一覧:実験レシピシリーズ
関連記事Recommend
-

細胞の免疫蛍光染色 実践編(2/2)
リケラボ実験レシピシリーズ
-

細胞の免疫蛍光染色 基本編(1/2)
リケラボ実験レシピシリーズ
-

細胞内でRNA干渉を人為的に誘導するために RNA干渉による遺伝子発現の調節(2/2)
リケラボ実験レシピシリーズ
-

RNA干渉(RNA interfering, RNAi)とは? RNA干渉による遺伝子発現の調節(1/2)
リケラボ実験レシピシリーズ
-

免疫沈降法(Immunoprecipitation)による目的タンパク質の濃縮 基本から応用まで
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(3/3)ウェスタンブロットによるタンパク質の検出
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(2/3)培養細胞抽出液のSDSポリアクリルアミド電気泳動
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(1/3)タンパク質実験をはじめるための基礎知識
リケラボ実験レシピシリーズ
-

リポフェクション法による遺伝子導入のプロトコル
リケラボ実験レシピシリーズ トランスフェクション(2/2)
-

遺伝子導入技術 トランスフェクションの基礎知識
リケラボ実験レシピシリーズ トランスフェクション(1/2)