化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

前項では、感度・特異性ともに優れたPCRを、定量性を確保しながら行うための要点を解説しました。この要点を理解することができれば、定量的PCR解析も難しくはないはずです。ここでは、「SYBR Green Iを用いたRT-PCR生成物の定量的リアルタイム解析」を例に、初期鋳型DNA量の算出方法を概説します。
*下記の定量的PCR専用試薬およびリアルタイムPCR装置を使用した参考例になります。 詳細は、製品のマニュアルをご確認ください。
<試薬> SYBR Premix Ex Taq II (Tli RNase H Plus) (TaKaRa社)
<装置> StepOnePlus Real-Time PCR System (Applied Biosystems社)
実験手順
1) PCRプライマーを設計する。
効率の良いリアルタイム解析を行うために、次の点に気をつけて設計する。
- プライマーの長さ: 17〜25塩基
- プライマーのGC含量: 40〜60%
- プライマーのTm値: 60〜65 ℃
- プライマーの配列: 全体的な塩基の偏りが無い。GC/ATリッチ部分がない。
- プライマーの相補性: プライマー内部/プライマー間でアニールしない。
- プライマーの特異性:目的以外のDNAに結合しないことを確認(BLAST検索など)。
2) PCR反応系を調製する
*1 ホットスタートPCR用のDNAポリメラーゼ(TaKaRa Ex Taq HS)を使用するため、サイクル前のミスプライミングやプライマーダイマーによる非特異的増幅が抑えられる。
*2 耐熱性RNase HであるTli RNase Hが添加されている。鋳型cDNA溶液(RT-PCR産物)に残存するmRNAによる、PCR反応の阻害を防ぐ。
3) PCR反応を開始する
下記の標準プロトコール(2ステップPCR系)でPCR反応を行う。Tm値が低いプライマーなど、2ステップPCR系での反応が不適の場合には、3ステップPCR系に変更するといった、PCR条件の至適化を行う。
<標準プロトコール(2ステップPCR系)>
Stage 1: 初期変性 (x 1サイクル)
95℃ 30秒
Stage 2 : PCR反応 (繰り返しx 40サイクル)
95℃ 5秒
60℃ 30秒
Stage 3: 融解曲線解析(PCR反応の特異性チェック)*3
*3 温度変化に伴ってCYBR Green Iに結合した2本鎖DNAが1本鎖に解離する際に見られる蛍光の変化を解析する。PCR増幅後に、目的のPCR生成物由来の蛍光変化とは異なる蛍光変化(プライマーダイマーなどの副産物由来)が混在していないかを調べることができる。
4) ソフトウェアを用いてPCR結果を定量的に解析する
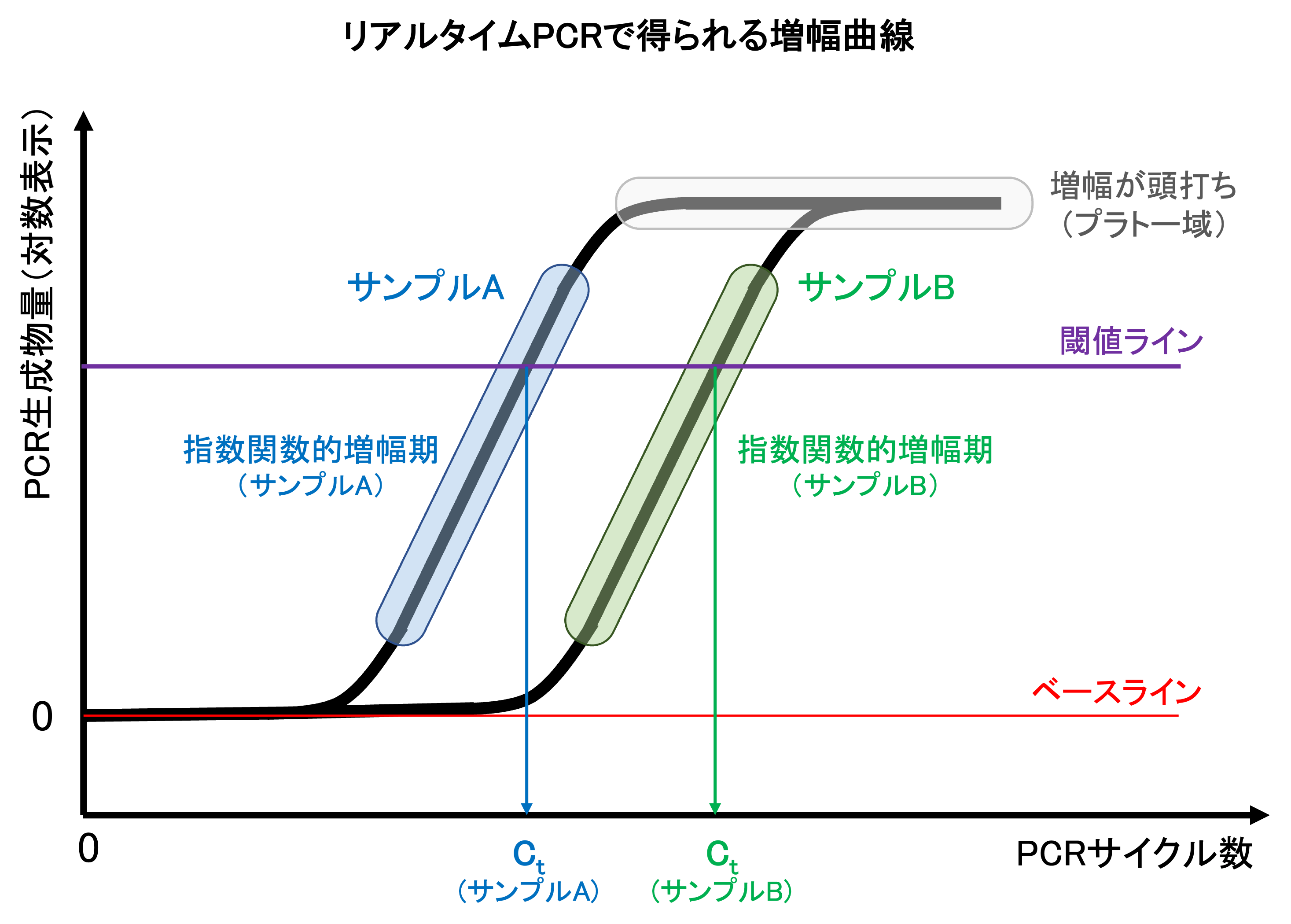
- ベースラインを設定する
PCR反応のバックグラウンドまたはノイズとみなされる低い蛍光シグナルを「ベースライン」と定義します。PCR初期の増幅曲線で見られる、蛍光強度の増加が検出されないサイクル数域での蛍光強度をベースラインとして設定する。 - 増幅曲線上で閾値(Threshold line)を設定する。
ベースラインに対して、統計学的に有意に増加しているシグナル強度を「閾値」と定義し、PCR増幅による得られる蛍光シグナルをバックグラウンドと区別する。全てのサンプルの増幅曲線が直線となる領域から、任意の蛍光強度(Y座標)を1点選択する(閾値)。 - 増幅曲線からCt (Threshold Cycle) 値を求め、初期鋳型量を算出する。
それぞれのサンプルについて、閾値を与えるサイクル数(X座標)を求め、Ct値とする(指数関数的増幅期の増幅曲線とThreshold lineの交点におけるX座標)[図]。Ct値は、鋳型DNAの初期量に反比例するため、Ct値から鋳型DNAの初期鋳型量を算出することができる。鋳型DNAの初期コピー数が少ないサンプルでは、Ct値は小さく、コピー数が多いサンプルではCt値は大きくなる。
このように、リアルタイムPCR装置を用いることで、任意のDNAやmRNAを簡単に定量できることをご紹介しました。配列が既知である任意のDNA/RNAに対して、それに対応するPCRプライマーを自由に設計することができるため、全ての内在性遺伝子に加えて、外来性の核酸(感染微生物のゲノムなど)の高感度かつ特異的な検出・定量も可能となります。
今や生命科学・医学分野において欠くことのできない「定量的PCR法」。次項では、その応用例をご紹介します。
*監修
パーソルテンプスタッフ株式会社
研究開発事業本部(Chall-edge/チャレッジ)
研修講師(理学博士)
この記事は、理系研究職の方のキャリア支援を行うパーソルテンプスタッフ研究開発事業本部(Chall-edge/チャレッジ)がお届けする、実験ノウハウシリーズです。
過去の記事一覧:実験レシピシリーズ
関連記事Recommend
-

細胞の免疫蛍光染色 実践編(2/2)
リケラボ実験レシピシリーズ
-

細胞の免疫蛍光染色 基本編(1/2)
リケラボ実験レシピシリーズ
-

細胞内でRNA干渉を人為的に誘導するために RNA干渉による遺伝子発現の調節(2/2)
リケラボ実験レシピシリーズ
-

RNA干渉(RNA interfering, RNAi)とは? RNA干渉による遺伝子発現の調節(1/2)
リケラボ実験レシピシリーズ
-

免疫沈降法(Immunoprecipitation)による目的タンパク質の濃縮 基本から応用まで
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(3/3)ウェスタンブロットによるタンパク質の検出
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(2/3)培養細胞抽出液のSDSポリアクリルアミド電気泳動
リケラボ実験レシピシリーズ
-

ウェスタンブロットによるタンパク質の発現解析(1/3)タンパク質実験をはじめるための基礎知識
リケラボ実験レシピシリーズ
-

リポフェクション法による遺伝子導入のプロトコル
リケラボ実験レシピシリーズ トランスフェクション(2/2)
-

遺伝子導入技術 トランスフェクションの基礎知識
リケラボ実験レシピシリーズ トランスフェクション(1/2)