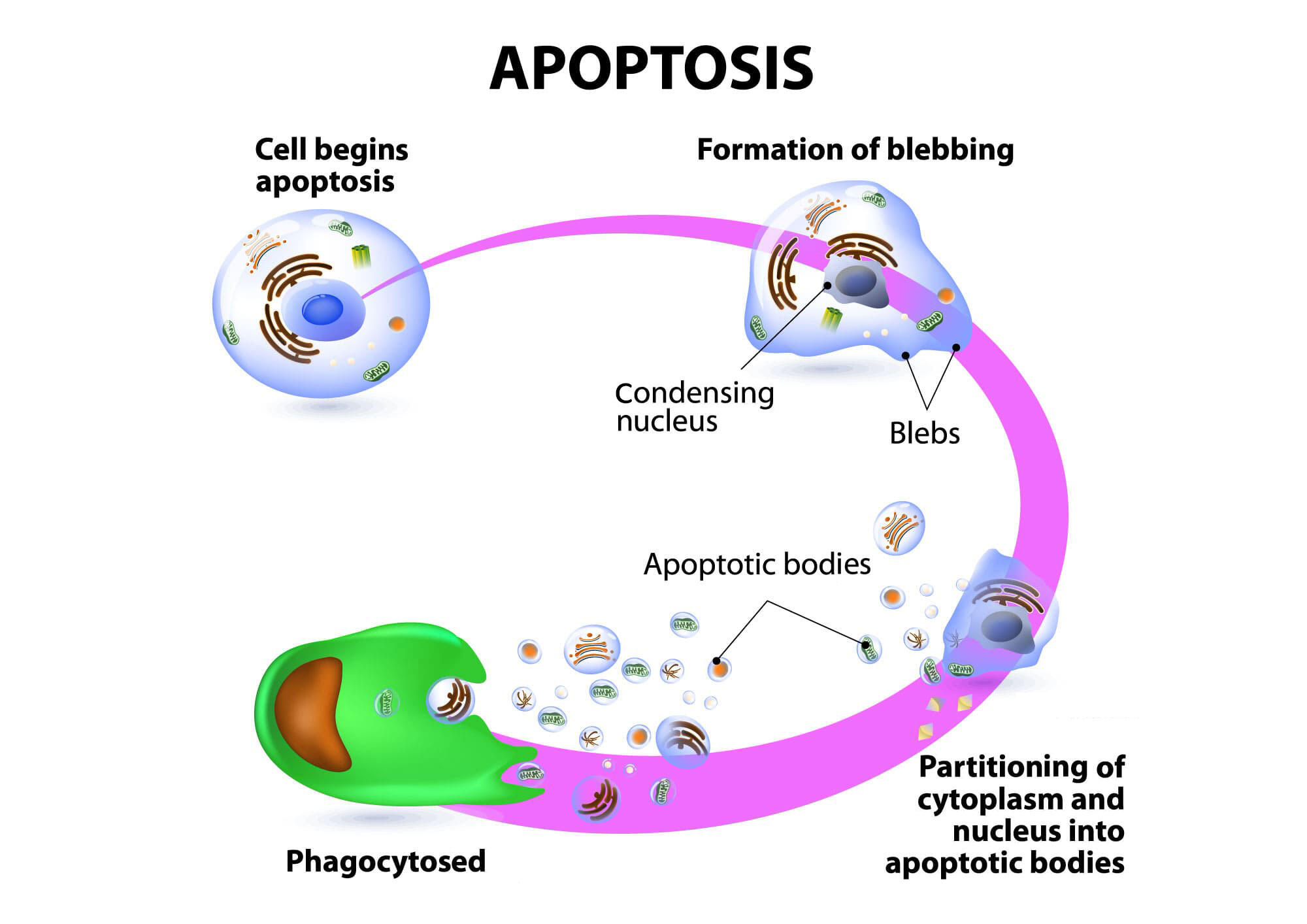
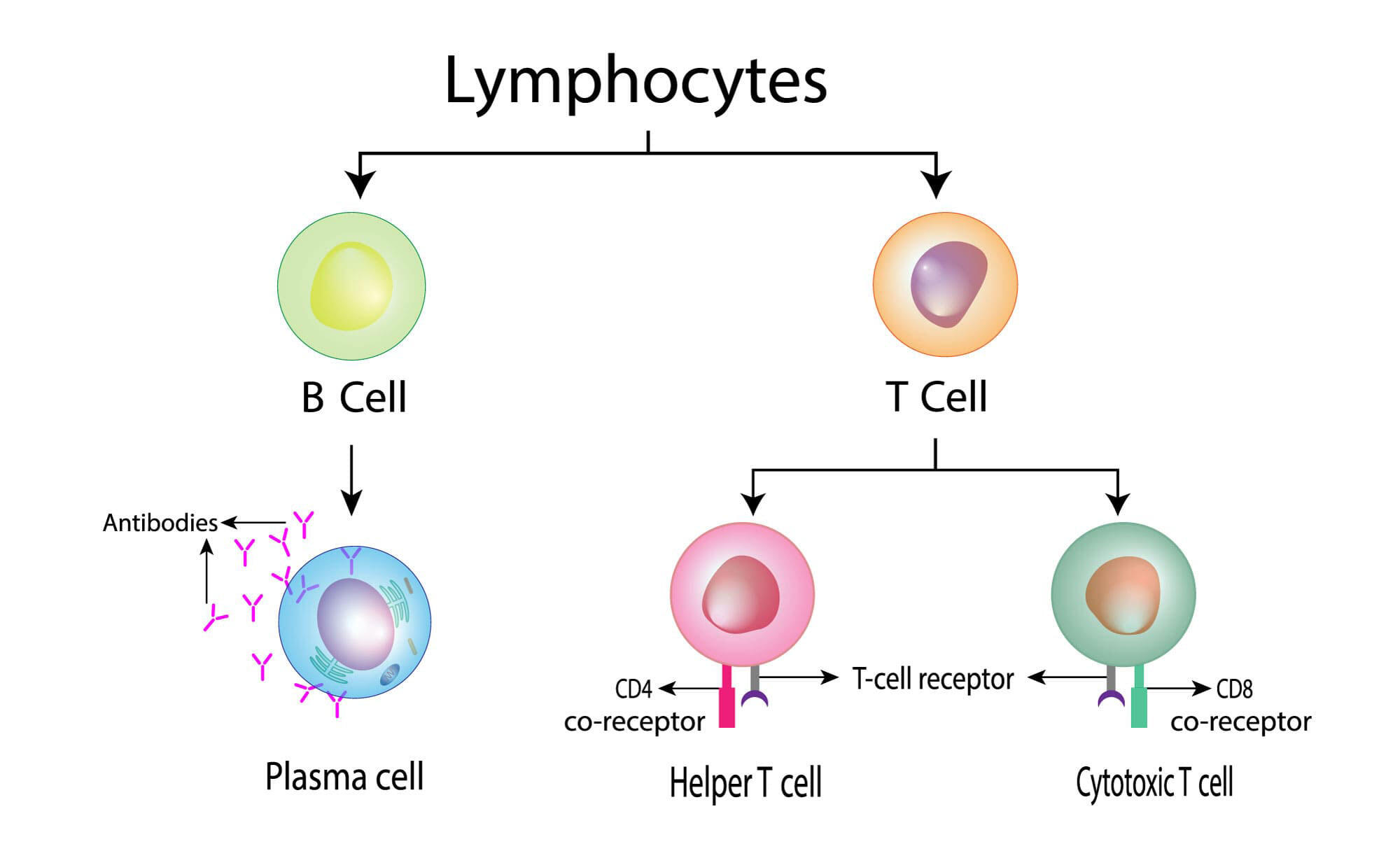
アポトーシスとは
私たちの体は37兆個もの細胞から構成されています。1つの受精卵から始まった生命は、細胞の増殖、分化を経て、多細胞生物としての個体となります。胚発生の時期には激しく細胞増殖が行われるのと同時に、決まった時期に、決まった場所で、決まった数の細胞死が起こることで初めて正常な発生過程が進みます。また、細胞の中には老化やウイルス感染、がん化など、さまざまな要因でDNA変異を持ったものが生み出されます。生物にとって脅威となりうるこれらの細胞を取り除くことも必要となります。このように発生における遺伝的にプログラムされた細胞死や異常な細胞の除去を行う機構がアポトーシスです。アポトーシスは、個々の細胞が自死することによって個体を生かす機構とも言えるのです。
アポトーシスが起きるとき、細胞膜は湾曲し、核の凝縮、断片化が起きます。さらに、染色体DNAの断片化が誘導され、最終段階では細胞自身が断片化され、食細胞またはマクロファージに取り込まれます。この細胞の死に方はそれまで知られていた細胞死の形態とは異なるものとして1960年代半ばにカー(Kerr)によって発見され、1972年にアポトーシス(apoptosis)と命名されました。この名前はギリシャ語のアポ(apo、離れる)とトーシス(ptosis、下降する)が合わさってできた言葉で、花弁や木の葉が落ちる状態に対してヒポクラテスが用いたものとされています。
アポトーシスの機能
能動的な細胞死を引き起こすアポトーシスは生体の重要な機能に関わっており、さまざまな条件で観察されます。例えば、正常組織の細胞周期、胚発生、がんの組織やさまざまな抗がん治療の組織(抗がん剤治療や放射線療法)細胞性免疫反応を起こしている組織などでアポトーシスを見つけることができます。中でも発生学の分野では、アポトーシスと命名される前からこのような細胞死は「制御された細胞死(programed cell death)」として知られていました。この制御された細胞死は、現在ではアポトーシスとほぼ同じものとして扱われています。またアポトーシスは、発生や個体形成だけではなく、生物の免疫系においても重要な役割を果たすことが分かりました。ここでは、発生・個体形成におけるアポトーシスと免疫系におけるアポトーシスについて紹介します。
<発生・個体形成におけるアポトーシス>
動物は発生段階で卵からさまざまな過程を経て成熟個体へと変化していきます。このとき、ある時期に必要な細胞が次の時期には不要になる場合があります。このような細胞は制御された細胞死によって取り除かれることになります。この細胞死のほとんどがアポトーシスによって行われます。
例えば、昆虫は卵から幼虫、さなぎ、成虫へと変態を遂げます。このとき、骨格節の細胞は全体が異なる細胞に入れ替わり、新しい骨格筋ができ上がります。この入れ替え時に発生する細胞死はアポトーシスによることが証明されています。他にもオタマジャクシがカエルになる際のエラや尾の消失もアポトーシスの顕著な例です。
このような個体形成に関わるアポトーシスは遺伝的に決められたもので、種によってパターンが異なります。例えば同じ鳥類でもアヒルでは後肢に水かきが発達しているため、ニワトリなどの他の鳥類と比較して指の間のアポトーシスが非常に少なくなっています。四肢のないヘビ類では、発生初期には存在する四肢の原基となる肢芽に広範かつ徹底的なアポトーシスが起こり、成熟個体では脚がなくなります。
生殖系細胞においても大量のアポトーシスが起きています。ヒトの場合卵巣には卵子が数十万個存在すると言われますが、一生のうちに排卵される卵の数はその数%に過ぎず、選抜されなかった細胞はアポトーシスにより除去されることが知られています。また、生殖器の形成にもアポトーシスが関与します。妊娠1カ月から2カ月の終わりごろの胎児にはウォルフ管とミュラー管と呼ばれるものが形成されています。ウォルフ管が発達すると男性生殖器に、ミュラー管が発達すると女性生殖器となります。男性では胎生期にミュラー管阻害因子と呼ばれるサイトカイン(生理作用を示す低分子のタンパク質)が分泌され、これがミュラー管に作用し積極的にアポトーシスを誘発することで男子ではミュラー管が退縮します。
<免疫系におけるアポトーシス>
生物の免疫系を調節する細胞としてリンパ球が知られています。リンパ球はウイルスなどに対する感染防御に関与する細胞であり、ウイルスに感染した細胞を認識すると増殖、活性化され、その細胞のアポトーシスによる除去を促します。一方で感染過程が終わると、この活性化されたリンパ球も速やかにアポトーシスによって除去されます。また、このような免疫系の働きを実現するため、リンパ球の一種であるT細胞はさまざまな抗原(免疫応答を引き起こす物質)と反応できる性質を持っていますが、中には自らの抗原(自己抗原)に強く反応してしまうものも出現します。これらはすぐに排除する必要があり、その除去もアポトーシスにより行われます。
このようにアポトーシスは免疫系においても重要な働きを持ち、うまく機能しない場合、自己免疫性疾患を引き起こしたり、がん遺伝子の働きでリンパ腫の発生が促進されたりと疾患に繋がります。エイズ患者における、HIVウイルス感染後のT細胞の特異的な減少もアポトーシスの誘導によるものと言われています。
アポトーシスの分子機構に切り込んだ日本人の研究
1970年代から報告されていたアポトーシスですが、その意義や分子機構は長く不明のままでした。それらに光が当たったのは1990年代、遺伝子レベルの解析が可能となったころのことです。そこにはある日本人研究者の活躍がありました。
生物学者の長田重一は、細胞の分子生物学的、生化学的な解析を行い、アポトーシスを分子レベルで理解するための突破口を開きました。
長田は東京大学で生物学を学んだ後、スイスのチューリッヒ大学で抗ウイルス作用を持つタンパク質であるインターフェロンの研究に取り組みます。大腸菌によるインターフェロンの大量生産法確立に関わった後、日本に戻りインターフェロンの研究を続けました。その研究の中で、当時の常識では考えられない現象を発見します。それは、共同研究者で当時東京都臨床医学総合研究所にいた米原がインターフェロンの働きを調べるためにインターフェロン受容体に対する抗体を作り細胞実験を行ったときのことです。細胞に抗体を加えることで、インターフェロン受容体と抗体が反応し、インターフェロンが機能しないようにして実験を行います。抗ウイルス作用を持つインターフェロンが機能しないため、この状態の細胞にウイルスを感染させると細胞が死ぬだろうと考えて行った実験でした。このとき、対照実験として、ウイルスを感染させずに抗体だけを細胞に与えた実験を行ったところ、なぜか細胞が死んでしまうという現象が見られたのです。この現象は予想に反するものでした。米原はこの不思議な現象を引き起こす抗体が認識する抗原をFasと命名しました。
長田は米原とともにFas抗原に関する共同研究を行いました。研究の結果Fasの単離に成功し、それがTNF(Tumor necrosis factor、腫瘍壊死因子)受容体ファミリーの1つであることが分かります。実際に、Fasを発現していない細胞にこの遺伝子を導入し発現させて、Fasの抗体を作用させたところ細胞は死滅することが明らかになりました。抗体で細胞が死ぬことが確認できたのです。さらに、その死に方を調べてみるとアポトーシスであることが分かります。アポトーシスの分子機構に光が当たった瞬間でした。長田らはこのFasを細胞にアポトーシスのシグナルを伝える受容体であると結論づけて米国の学術誌『CELL』に論文を投稿し、1991年に掲載されました。
長田はその後もアポトーシスの研究を続け、マウスのFasが染色体19番に存在し、Fas遺伝子の変異がマウスの自己免疫疾患に関連すること、Fasの活性化がマウスにおいて肝炎を起こすことを明らかにします。さらに、Fasの欠陥による疾患は、ヒトの免疫疾患の患者でも見出され、ヒトのある種の白血病細胞がFas遺伝子に変異を持つことも発見します。アポトーシスの異常が細胞をがん化へと導くことも明らかにしたのです。
まとめ
私たち生物が成長したり、生命を維持したりするとき、細胞の分化や増殖が重要であるのはもちろんですが、計画的に進められる「死」も重要なのです。アポトーシスの発見とその分子機構の研究は、生物の「生」をより深く理解するために必要な知見を与えてくれます。がんやエイズ、自己免疫疾患といった疾患にもアポトーシスが関わっており、その研究がこれらの治療法の開発につながる日が来るかもしれません。
記事執筆:吉田拓実(東京大学大学院 農学生命科学研究科 博士課程修了 博士(農学)/ 再考編集室 編集記者 / さいこうファーム 農場長)