リケラボは研究者、研究開発・技術職など理系の知識を生かしてはたらきたい人を応援する情報サイトです。

みなさんこんにちは、ライターの笹沼です。バリバリの文系の私が、理系の研究室に突撃取材する本企画。知識はまったくナシ、憧れと興味だけを胸に、失礼を承知で「何の研究をしているんですか??」とズカズカ聞いてみたいと思います。
第4回目の今回お話を伺ったのは、横浜薬科大学 生化学研究室の、小笹徹教授です。このシリーズも4回目ですが、やっぱり緊張する……。
よいタンパク質を作ることに30年。
Gタンパク質共役受容体(GPCR)と創薬
研究室にお邪魔すると、病院と同じ匂いがしました。さすが薬科大学という感じ(?)です。小笹先生にご挨拶すると、とっても穏やかな雰囲気で優しそう。今回もホッとしました……。それでは先生、よろしくお願いします!
さっそくですが、小笹先生はどんな研究をされているのですか?
Gタンパク質を介した、細胞情報伝達の分子機構について研究しています。
じ、Gタンパク質……? 細胞情報伝達……? さっそく難しいです……!
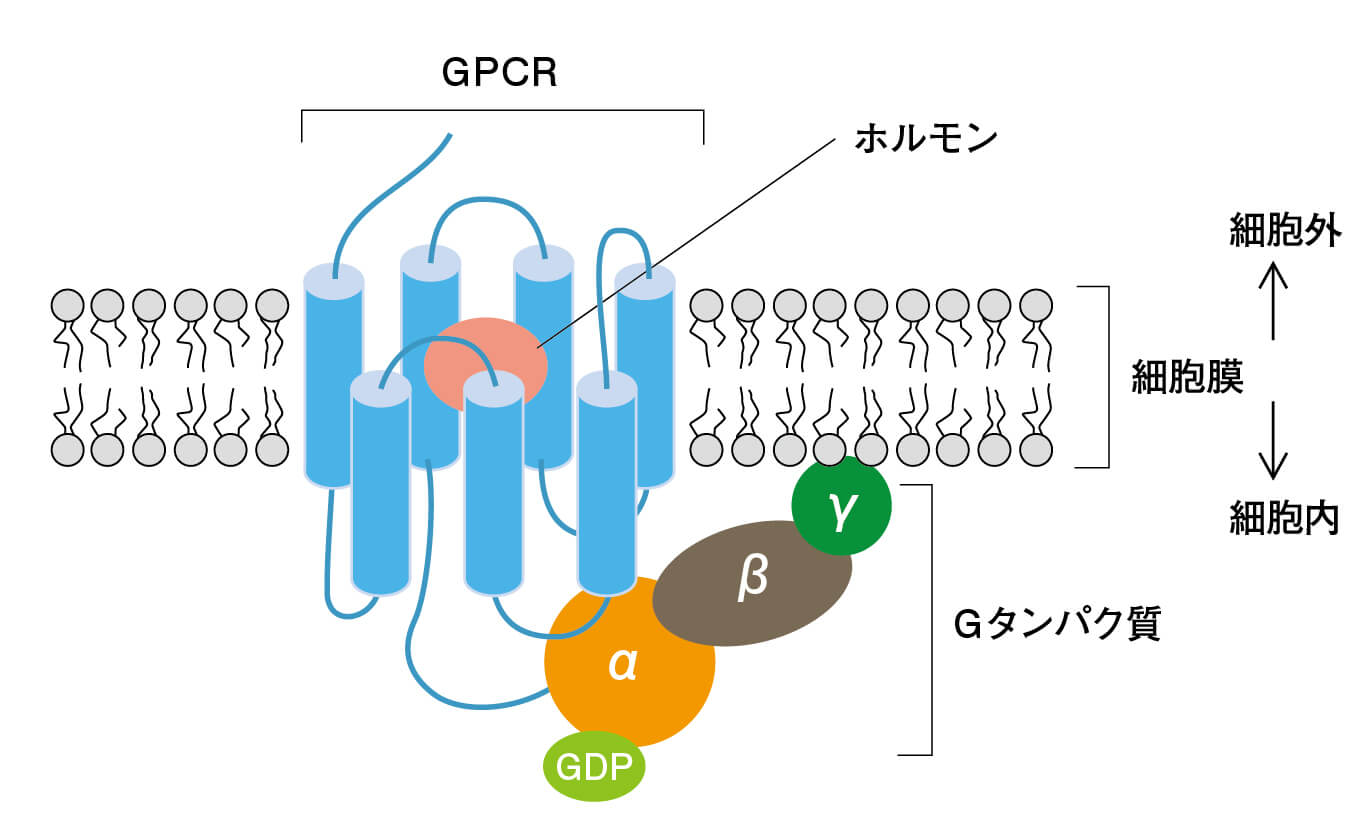
Gタンパク質とは、“グアニンヌクレオチド結合タンパク質”のことで、細胞のシグナル伝達に関わる働きをするものです。人間の身体は、外界から受け取った何らかの刺激や情報に対して反応する際のひとつの方法として、ホルモンを分泌します。そのホルモンが、細胞の膜にある“Gタンパク質共役受容体(GPCR)”というタンパク質にくっつくと、GPCRの形が変化して、Gタンパク質と結合します。
すると、Gタンパク質に結合していたGDP(グアノシン二リン酸)が離れて代わりにGTP(グアノシン三リン酸)が結合し、今度はGタンパク質の形が変化して、活性型となりシグナルが細胞のなかに伝えられます。このように、細胞の外から受け取った情報が、タンパク質の構造変化として変換されていきます。つまり、Gタンパク質が細胞膜のところで、スイッチの役割を果たしていろいろなシグナルを伝達し生体反応にさまざまな変化をもたらすのです。
Gタンパク質共役受容体(GPCR)の模式図
生体反応の変化……私たちが日ごろ感じる身近な例でいうと、どんなことでしょうか?
たとえば、興奮すると心拍数が上がりますよね。この場合でいうとまず、自律神経の交感神経から血液中に分泌されたノルアドレナリンが、心臓のアドレナリン受容体にくっつく。それを受けてアドレナリン受容体に共役している(=結びついている)GsというGタンパク質が、細胞中のサイクリックAMP(Gタンパク質からのシグナルを細胞内に伝える物質)の量を増やして、「心拍数を上げろ」という具体的な信号に切り替えてくれるのです。そうすることで、実際に心拍数が上がってドキドキするわけです。光が網膜の受容体にくっつくと、網膜のGタンパク質(Gt)が活性化されて網膜の神経細胞が興奮し、光のシグナルを脳に伝えることで物が見えるようになります。暗闇でも慣れれば目が見えてくる現象は、暗闇では明るい場所よりも、Gtが活性化されやすくなる仕組みが働くためです。匂いを感じられるのも、匂い物質が受容体にくっついてGタンパク質が活性化し、シグナルを送るから。ちなみに、800種類以上あるGPCRのうち半数以上が嗅覚を伝える匂いの受容体です。
嗅覚が半数以上! 匂いに関係する受容体はそんなにたくさんあるのですね!
ひとつの匂い物質に対してひとつの受容体があるので、それだけたくさんの数になりますし、今でこそ人間は視覚が発達していますが、進化の歴史をたどれば「嗅覚で見ていた」ともいえるくらい、匂いでいろいろな情報を得ていました。ほかの生物を見ても、視覚がそれほど発達していなくて、嗅覚を頼りに行動しているものがたくさんいますよね。
もちろん先ほど例を挙げたように、GPCRは嗅覚以外にも、残りの半数のうち2/3が神経系や内分泌系などの生理機能に関わっています。そのため、世の中にある薬の約1/4(売上としては50%以上)は、GPCRをターゲットにしているんです。
そんなにも多くの薬がGPCRをターゲットにしているんですね!
たとえばどんな薬がどのようなしくみで症状を抑えているのでしょうか。
高血圧や狭心症の治療薬である、“ベータ遮断薬(プロプラノロール)”は、心臓にあるアドレナリンベータ受容体に結合することで、交感神経から出るノルアドレナリンによる心臓の興奮を抑えたり、胃潰瘍の治療薬である“ヒスタミンH2遮断薬(シメチジン)”は、胃の細胞ヒスタミンH2受容体に特異的に結合して、ヒスタミンによる胃酸の分泌を抑えたりします。プロプラノロールとシメチジンは、どちらもイギリスのジェームズブラック博士が開発した薬で、高血圧心臓病や胃潰瘍の治療に大変大きな貢献をしています。ブラック博士は、これらの業績で1988年にノーベル賞を受賞しているのですよ。
高血圧や狭心症、胃潰瘍は身近な病気ですが、治療薬が症状を抑えるしくみについて意識したことがなかったので、とても興味深いです。そして、ノーベル賞を受賞しただなんてすごい……!
ほかにも、GPCR関係のノーベル賞は非常にたくさんありますよ。たくさんのノーベル賞を受賞しているということは、GPCRやGタンパクへの注目度が高いことを示しているともいえますね。まずは、エール・サザランド先生が“サイクリックAMP”という物質がGタンパク質からのシグナルを細胞内に伝える物質(セカンドメッセンジャーと呼ぶ。ちなみに細胞の外からの刺激をファーストメッセンジャーと呼んでいます)であることを発見して、1971年に受賞。その後、アルフレッド・ギルマン先生とマーティン・ロッドベル先生が、Gタンパク質の発見で1994年に受賞されています。ほかにも、GPCRに作用するホルモンの発見で受賞した方もいたり……最近では、ロバート・レフコヴィッツ先生とブライアン・コビルカ先生が、GPCRとGタンパク質の複合体の構造を解明して2012年に受賞されました。
こんなにたくさんの賞が贈られているなんて、Gタンパクのメカニズムは人類にとって本当に大切なものなのですね! 小笹先生は、なかでもどんな研究を専門にされているのですか?
だいたい20種類あるといわれているGタンパク質のうち、私が専門にしているのは、“G12”と“G13”というタンパク質です。これらのGタンパク質は、細胞の形を決めたり、細胞の運動などに関わっています。増やしたり、動いたり、分裂したりといった部分です。そして、このG12やG13の活性型のタンパク質を細胞のなかで発現させる実験をすると、シャーレのなかで細胞が異常に増殖します。つまり、がん化です。このようにG12 / 13は、がんに関係していることがほぼ確実視されています。
がんに関係するGタンパク質があるのですね。先生は、G12 / 13の研究を、がんの治療に役立てようと考えていらっしゃるのですか?
私は、がんの“転移”を抑える薬を開発したいと考えています。現代は長生きする人が多く、がんを発症する人の数も増えました。そんななか、直接の死因になるのは原発巣よりも、転移であることが多いのです。結局、転移を防げるかどうかというところが、患者さんのQOL(クオリティ・オブ・ライフ)を左右するのではないでしょうか。従来の治療法と組み合わせながら使っていくことで、患者さんが楽しく生活できる期間が少しでも長くなればいいと考えています。
ちなみに、実現までの見通しはすでについていたりするのでしょうか?
じつは、もう少しというところまでは来ています。ただ、その“もう少し”のところをのり越えて、薬にするまではなかなか難しいのです。がん細胞の増殖そのものを抑える薬や、免疫療法などの治療法はいろいろなところで研究されていますが、転移を抑えることにフォーカスした医薬品開発は今のところあまりメジャーではありません。地道に研究を続けていく大変さはありますが、良いGタンパク質をつくることに30年間費やしてきた私なりの貢献ができるよう、今後もしぶとくやっていこうと思っています。
留学先の先生がノーベル賞受賞!
ご自身も細胞のがん化に関わるG12/13のシグナル伝達の仕組みを解明!
小笹先生は、どうしてGタンパク質の研究をしようと思われたのですか?
医学部在学中に受けた内分泌内科の先生の講義がすごく面白くて、内分泌を専門にやってみようと思ったのが、いちばん最初のきっかけでしょうか。その後、研修医として内分泌内科に行った際、最初のころに「偽性副甲状腺機能低下症」の患者さんの担当医になりました。「偽性副甲状腺機能低下症」は、ホルモンの応答がうまくいかないことによって血液のカルシウム濃度が低下し、身体にさまざまな症状が現れてしまうというもの。病気の状態を検査するため、患者さんにいくつかのホルモンを投与し、ひとつひとつ反応を見るなどしていました。そんなとき、指導医の先生に「これを読んでみなさい」と、ロッドベル先生が1980年に発表した論文を渡されたんです。現在では20種類ほど発見されているGタンパク質のうち、当時はGsとGtのふたつしかわかっていなかったのですが、論文では「Gタンパク質によるシグナル伝達のメカニズムは、細胞情報伝達にとってユニバーサルなものであろう」と書かれていました。つまり、いろいろなホルモンが同じ情報伝達の仕組みを使っているに違いないと予想していたわけです。この予想は、その後の研究で予想通りだったということがわかりました。そのころは私も若かったので、やっぱり大きな仕事をしたいと思っていたっていうか……(笑)。一般的な法則を発見するなどして、たくさんの人の役に立つことをしたいと考えていました。そんななかこの論文を読んで、非常に面白そうだと思いました。
そのまま、医師には戻らずに研究者になられたのですか?
当時は、臨床と基礎研究の間がかなり離れていて、臨床にいながら研究をすることが今よりも難しかった。だから、Gタンパク質の研究をするために東京大学大学院へ行くことにしました。ただ、本郷の東大医学部の中ではGタンパク質を扱っている研究室がなくて……いちばん近い「GTP結合タンパク質」を研究している、白金台にある東京大学医科学研究所にいらした上代淑人先生の研究室に行かせてもらいました。そこで「Gタンパク質の研究をしたい」と言ったら、「ちょうどこれから研究しようと思っていたんだよ」と言ってもらえた。そのときは、こんなタイミングの良い話、本当かなあと思いましたね(笑)。それからは、5年ほどかけて、当時確立されたばかりだったGタンパク質の精製法(タンパク質精製:DNAや他のタンパク質が混ざらないように、研究対象のタンパク質だけを取り出す)を使って、GsというGタンパク質の遺伝子をクローニング(クローニング:遺伝子DNAを単離すること)し、解析しました。その後、偽性副甲状腺副甲状腺機能低下症の患者さんでは、この遺伝子に異常があったためGタンパク質の設計ミスが起き、正常に機能しなくなっているためホルモンへの応答がうまくいっていないということもわかりました。
そこまでたどり着いて、また臨床に戻るか、それとも生化学の研究の道に進むかという大きな分かれ道にさしかかりました。臨床に戻るかどうか随分考えましたが、せっかくここまで研究してきたということで。医者として、一人ひとりの患者さんを診ることはもちろんとても大切ですが、私の場合は、病気の原因やメカニズムを分子のレベルで解明していきたいと思ったわけです。そして医薬品の開発などにつなげられれば、よりたくさんの人の治療につなげられるのではと考えて、研究の道へ進むことを決めました。
それから、上代先生のもとで引き続きGタンパクの研究をしていると、アメリカのアルフレッド・ギルマン先生の論文がいつも先行して出てくるんです。そのたびに、「あ~、まただ~……」と(笑)。それで、この先生のもと(テキサス大学サウスウエスタンメディカルセンター)に行かなければと思い手紙を書きました。すると、「今は満員だけど、1年待ってくれたら入れるよ」と返事をもらえて、短い手紙でしたがとてもうれしかったですね。そのころは留学するのが当たり前で、帰国後のポストが保証されていなくてもとにかく日本を出る人が多かったです。ちなみに、ギルマン先生は私が留学しているときにノーベル賞を受賞されて、そのときはもうお祭り騒ぎでした。
ノーベル賞受賞を目の当たりにされたのですね! ギルマン先生のところではどんな研究をされていたのですか?
私がギルマン先生のもとで取り組んだ研究テーマは、Gタンパク質のなかでも当時まだほとんど何もわかっていなかった“G12 / 13”タンパク質の精製、そのシグナル解析や、標的分子の特定です。まずはこのタンパク質の精製方法の確立に5年かかってしまいましたが、全体では7~8年ほどかけてシグナル伝達の仕組みを新しく突き止めることができました。このときの研究テーマはギルマン先生の研究のメインストリームではなかったので、まるごと自分の専門分野として切り出して独立でき、今でも研究を続けられるのは非常に幸運なことでもありました。
現在も研究されているG12 / 13のシグナル伝達の仕組みは、小笹先生ご自身が突き止めたものなのですね!
論文が出たとき、私は家族と夏休みの一時帰国で日本に帰っていたのですが、イリノイ大学シカゴ校医学部薬理学教室のチェアマンから突然電話がかかってきて、「あなたを雇うことに決めた」と(笑)。その後はシカゴに行って研究を続けました。ちょっと強引な感じにも思えますが、良い研究者がいたらみずからの全責任のもと即決するというやり方が、アメリカだからこそのシステムだったわけです。ちなみに、研究費の申請システムにもアメリカならではのところがあって、申請をすると数ページに渡ってかなり細かいレビューが返ってきます。「ここが欠けている」とか「こういう結果がない」とか……反対に言えば、その指摘をもとに直せればクリアできるということなので、審査員の方たちもすごく大きな責任を持っています。その分野で一流の研究者としてすでに認められた研究者ではなく、研究の最前線にいる現役バリバリの比較的若い世代がグラントを審査していることがアメリカの大きな特徴ですね。この点は、日本と随分違うところだと思います。
ポジティブに励まされた経験が、
次の世代の背中を押す!
結局、アメリカでは何年ほど研究を続けられたのですか?
20年ほどですね。
それにしても、ひとつの研究に7~8年もかかるなんて、私だったら挫折してしまいそうです。小笹先生はどうして続けられたのですか?
研究中は、果たしてうまくいくのかどうかもわからないし、先も見えず非常に苦しい気持ちになることももちろんありました。でも、ギルマン先生がつねにポジティブに励ましてくださいました。とても忙しい方だったので話せる機会も頻繁にはなかったのですが、怒られたり急かされたりするわけじゃなく、「これは良い結果だから続けてみなさいよ」と、声をかけてくれる。おかげで、たびたび勇気をもらいました。ギルマン先生には本当に感謝しています。実験は、9割以上は思い通りにいきません。ですが、それは失敗ではないんです。結果を素直に受け止めて、なぜ思い通りにいかなかったのか、どこを間違えてしまったのか考えて次の実験につなげることが大切で、絶対にムダな実験はありません。まさに、継続は力なりです。
現在取り組んでいる、がんの転移を抑える薬の研究も、“あともう少し”とは言ったものの本当に実現できるかどうかはまだわかりません。でも、成し遂げられなかったとしても、それは次の世代に渡せればいいと考えています。私にできることといえば、これまで得られたことを次の世代に伝えること。だから、若い世代にはポジティブに研究に取り組んでほしいですね。私自身もギルマン先生にそうしてもらったように、若い研究者たちを励ましていきたいと思っています。
──先が見えなくてつらいときにも、自分が尊敬する人に励ましてもらえれば、また頑張る力が湧いてくる気持ち、わかります! 若い研究者の方々も、先生のような師に出会えたら、とても心強いでしょうね…。それに、ご自身の世代では達成できないかもしれなくても、次世代のためにといって人生をかけて研究を続けてこられたお気持ちが、本当にすごいです…。そうやって一人一人の研究者の方が地道に研究を重ねてこられたからこそ、科学が進歩してきたのですよね…。先生の研究人生の重みに尊敬の気持ちでいっぱいです。
また、Gタンパク質が、身体中のさまざまな情報伝達を担っているということを知ることができたこともとても興味深かったです。これからは身体の変化を感じるたびに、「Gタンパク質働いてる……」と意識してしまいそうです。がんの転移を抑える薬も、実現できることを願っています。小笹先生、本日はお忙しい中、本当にありがとうございました!
小笹 徹 先生
横浜薬科大学 健康薬学科/生化学研究室、保健管理センター教授。医学博士。
1980年東京大学医学部医学科卒業。1988年東京大学大学院医学研究科博士課程修了。1989年東京大学医科学研究所助手。1991年テキサス大学サウスウエスタンメディカルセンター博士研究員。1995年同助教授。1999年イリノイ大学シカゴ校医学部薬理学教室助教授。2002年同准教授。2010年東京大学先端科学技術研究センター特任教授。2011年から2015年までイリノイ大学シカゴ校医学部薬理学教授を兼任。2016年より東京大学先端科学技術研究センター客員研究員。
(※所属などはすべて掲載当時の情報です。)
▼研究室訪問・医薬品開発に関連する記事
・その研究私も理解したい!文系女子が最先端の理系研究室に突撃取材(その1 計量生物医学編)
・その研究私も理解したい!文系女子が最先端の理系研究室に突撃取材(その2 生殖医学編)
・まだまだ見つかる! 理系シゴトに進む道 Vol.3(医薬品研究開発)
関連記事Recommend
-

スキンケアの疲労回復効果を検証!日常に取り入れる「疲労の科学」
~大阪公立大学健康科学イノベーションセンター~
-

「子どもたちを心臓の再手術から救いたい」――。思いを叶えるために根本教授が採ったユーザーイノベーション戦略
心・血管修復パッチ「シンフォリウム®」開発のキーマンに聞く「医師にしかできないサイエンス」とは
-

iPS細胞の実用化に向けた挑戦
京都大学iPS細胞研究財団
-

栄養学の新潮流「時間栄養学」とは? 私たちの健康を左右する、食事と体内時計の密接な関係に迫る!
-

次のパンデミックに備え、社会により貢献できる研究を目指して 慶應義塾大学医学部 感染症学教室 南宮 湖
臨床と研究をつなぎ国際保健に活かす「フィジシャン・サイエンティスト」を実践
-

CRISPR-Cas9の精度を飛躍的に高める「セイフガードgRNA」を開発した、九州大学川又助教の発想法
-

折り紙技術を駆使して宇宙から血管、さらに細胞にも活用。いつも自分で道を切り開いて歩み続ける研究者、繁富(栗林)准教授
-

「一回の決断で人生は終わるわけではない」
イスラエルのフードテック企業で活躍する杉崎麻友さん- 広がる研究キャリアの選択肢 -
-

日本のライフサイエンスを世界へ!
スタートアップ支援から街づくりまで、研究を強力にバックアップするサイエンスコンシェルジュとは― 三井不動産 三井リンクラボ ―
-

先入観や固定概念を捨てる!仮説を立てない実験アプローチで「疲労」と「眠り」のメカニズムを解明